
Article paru dans Réalités Ophtalmologiques – n° 309 Mars 2024 – Arnaud Bernard, Clinique des Yeux, Bordeaux
Les injections intra-vitréennes régulières d’anti-VEGF sont devenues le mode de prise en charge habituel dans des pathologies telles que la DMLA néovasculaire et l’œdème maculaire diabétique. Bien qu’elles aient démontré leur efficacité, ces molécules nécessitent de maintenir un rythme d’injection élevé et des visites fréquentes avec une contrainte importante pour les patients et l’assurance-maladie. De nouveaux régimes de traitement comme le “treat and extend” et des molécules d’action prolongée comme le brolucizumab ou le faricimab ont été développés afin de réduire la fréquence des injections sans compromettre les résultats initiaux. De nouvelles formes de délivrance des anti-VEGF ont également été évaluées comme le Port Delivery System et la thérapie génique, qui utilise des vecteurs viraux pour permettre la production de protéines anti-VEGF par les cellules rétiniennes, apportant l’espoir d’un traitement unique dans ces pathologies.
La dégénérescence maculaire liée à l’âge (DMLA) néovasculaire et la rétinopathie diabétique constituent une cause majeure de basse vision dans la population [1]. Le VEGF-A (facteur de croissance de l’endothélium vasculaire) est depuis de nombreuses années considéré comme l’élément central de ces processus pathologiques et constitue la cible principale des thérapeutiques actuellesqui se lient à lui ou le neutralisent [2]. Les traitements anti-VEGF ont complètement changé le pronostic et la prise en charge de la DMLA néovasculaire et de l’œdème maculaire diabétique. Ils sont devenus le traitement de référence à la fin des années 2000. Les molécules actuellement utilisées (bevacizumab, ranibizumab et aflibercept) permettent d’obtenir une évolution globalement favorable [3, 4].
Bien que le pronostic visuel se soit amélioré, cela s’est accompagné d’une forte contrainte pour les patients et d’un coût important pour les systèmes de santé. Du fait de la nature chronique de ces pathologies et de la durée d’action des agents anti-VEGF, il est nécessaire de maintenir, dans la majorité des cas, un rythme d’injection intra-vitréenne (IVT) régulier mensuel ou bimensuel. De plus, les résultats des études de vie réelles restent inférieurs aux études pivot (Marina, Anchor, View) où le rythme des traitements était rigoureusement respecté [5]. Il est alors apparu évident que ce rythme était difficile à supporter sur le long terme. On note également, dans la DMLA, que les injections continues d’agents anti VEGF entraînent fréquemment des phénomènes de fibrose des membranes néovasculaires, avec une dégradation des résultats visuels initiaux.
Les études plus récentes ont exploré de nouvelles modalités de prise en charge comme le “treat and extend”, proposé initialement par Richard Spaide et largement repris depuis dans différentes études (TREND, ALTAIR) [6, 7]. Ces nouveaux régimes de traitement diminuent la fréquence des injections tout en maintenant les résultats anatomiques et fonctionnels. La volonté d’obtenir une action thérapeutique prolongée a conduit au développement de nouvelles molécules anti-VEGF, comme le brolucizumab et le faricimab, et à de nouvelles formulations comme l’aflibercept 8 mg qui ont montré dans des essais cliniques de phase III le maintien d’une efficacité comparable aux molécules initiales, mais avec des intervalles d’injection allant jusqu’à 12 voire 16 semaines [8, 9].
De nouvelles forme de délivrance des anti-VEGF ont été proposées, comme le Port Delivery System (PDS), le KSI-301 qui est une association d’un anticorps anti-VEGF avec un biopolymère pour augmenter sa durabilité.
Enfin, la thérapie génique se propose de produire localement et de façon permanente une protéine anti-VEGF via un gène intégré dans les cellules cibles de la rétine, apportant l’espoir d’un traitement simplifié par une procédure unique [10].
Le Port Delivery System ou Susvimo (Roche/Genentech)
Alors que les nouveaux agents thérapeutiques permettent d’obtenir des intervalles d’injection jusqu’à 16 semaines, ils représentent toujours une contrainte à long terme pour les patients. Le Port Delivery System (PDS) va plus loin et permet une action de 6 mois ou plus avant une recharge [11-13]. Il s’agit un réservoir intra-vitréen placé par une incision sclérale de 3,5 mm en pars plana (fig. 1). Il contient un petit volume de ranibizumab hautement concentré qui est lentement libéré dans la cavité vitréenne par diffusion passive, permettant la délivrance continue de ranibizumab sur une période étendue.
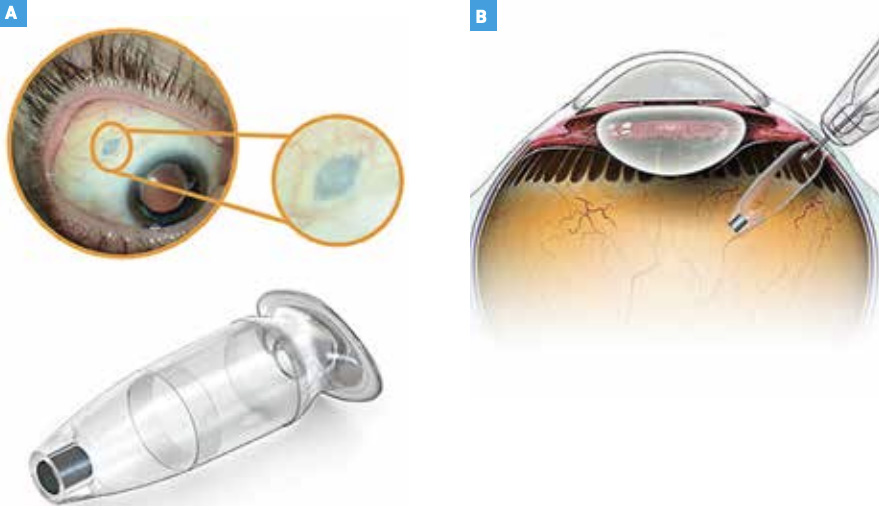
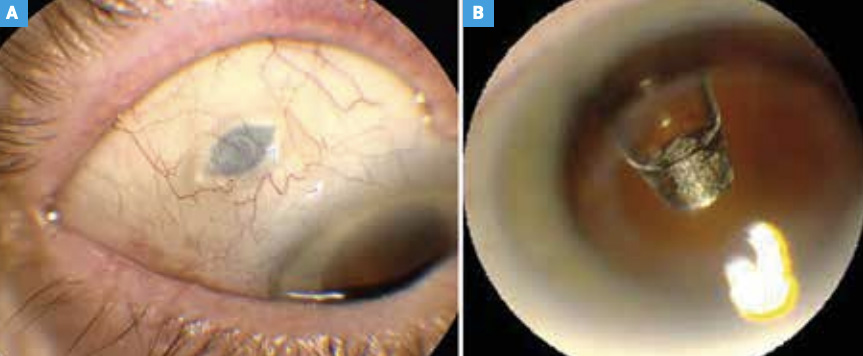
Il est composé d’un septum auto-étanche au niveau de son attache sclérale (fig.2A). Il est rechargé avec une aiguille spécifique double courant (fig. 2B). Au niveau de l’autre extrémité, un élément métallique microporeux permet la libération passive de la molécule (fig. 3A et B). Son utilisation a été approuvée par la FDA en octobre 2021.
>>> L’étude de phase II LADDER [11], réunissant 220 patients, a évalué l’efficacité du PDS dans la DMLA néovasculaire comparée à une procédure mensuelle IVT de ranibizumab 0,5 mg. Elle démontre que le dispositif avec une formulation dosée à 100 mg/mL n’est pas inférieur au groupe ranibizumab mensuel en termes d’amélioration de l’acuité visuelle (AV) avec cinq fois moins d’injections et un délai moyen de recharge de 15,8 mois. À 22mois, la variation de l’acuité visuelle ETDRS était de + 2,9lettres dans le dosage 100 mg/mL vs + 2,7 pour le ranibizumab mensuel. On note peu d’effets secondaires (4,5 % d’hémorragies intra-vitréennes légères).
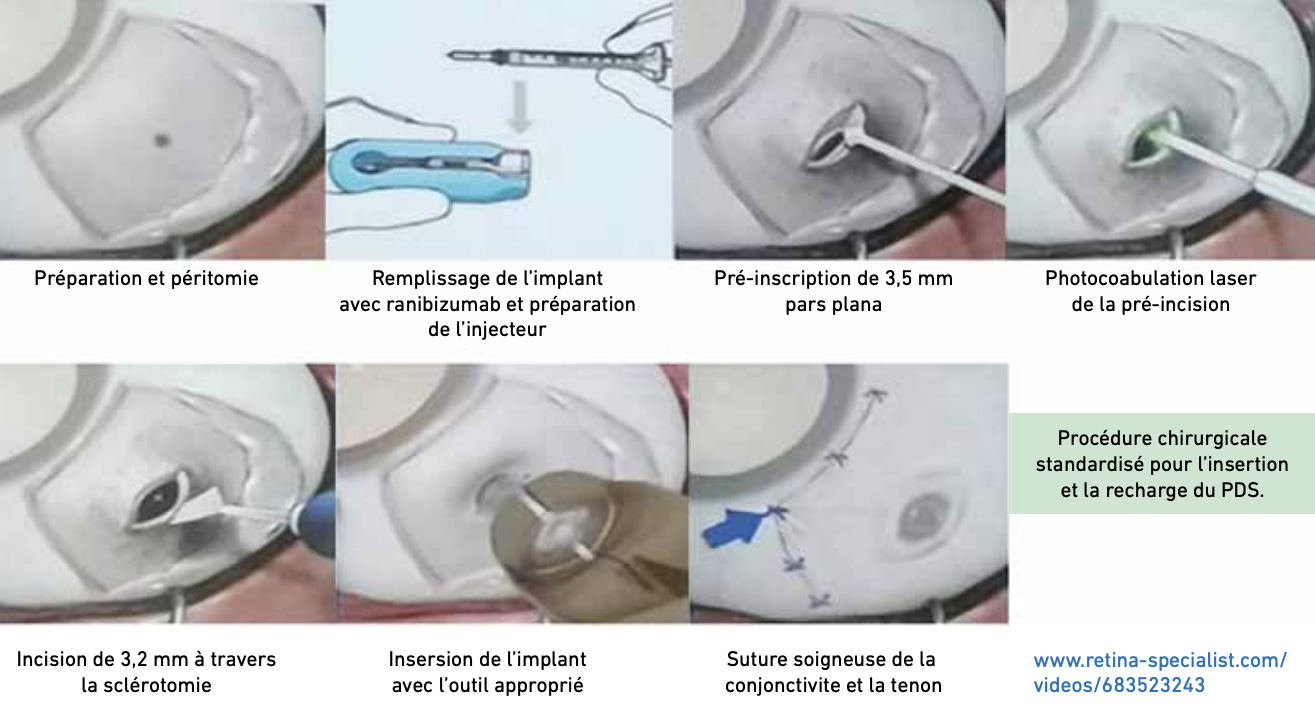
>>> L’étude de phase III ARCHWAY[12], regroupant 418 patients, a comparé l’efficacité et la tolérance du PDS 100 mg/mL face au ranibizumab, avec 251 patients dans le bras PDS rechargé à 24 semaines et 167 dans le bras ranibizumab mensuel. La variation de l’acuité visuelle ETDRS à 40 semaines était de + 0,2 lettres ETDRS dans le bras PDS et + 0,5 pour le ranibizumab. La plupart des patients implantés (98,4 %) n’ont pas eu besoin d’injection supplémentaire en dehors de la réinjection de recharge programmée à 24 semaines (Q24W). Il n’y avait pas d’infériorité par rapport au ranibizumab mensuel en termes de résultat fonctionnel et seulement 1,6 % de réinjections supplémentaires à 40 semaines.
Cependant, les effets secondaires et complications du PDS sont plus nombreux: 47 patients (19 %) dont quatre endophtalmies (1,6 %), deux décollements de rétine (0,8 %), onze cataractes (4 %), trois déplacements du septum (1,2 %) et quatre dislocations de l’implant.
>>> Deux études de phase III, PAVILLON [13] et PAGODA, ont également évalué le PDS dans la rétinopathie diabétique et l’œdème maculaire diabétique :
– PAGODA retrouvait à 1 an une noninfériorité du PDS 100 mg/mL rechargé toutes les 24 semaines face au ranibizumab mensuel avec une amélioration de l’AV respectivement de 9,4 et 9,6 lettres ETDRS par rapport à l’AV initiale;
– l’étude PAVILLON (176 patients dont 106PDS) retrouvait à 1an une supériorité du PDS 100 mg/mL rechargé toutes les 36 semaines face au ranibizumab mensuel avec une amélioration de deux niveaux ou plus du DRSS (Diabetic Retinopathy Severity Score) dans 80% des cas contre 9 % dans le groupe contrôle, avec peu d’effets secondaires (pas d’endophtalmie ni de dislocation du septum).
Malgré ces bons résultats, les risques de dislocation du septum ont amené en octobre 2022 Roche/Genentech à suspendre les nouvelles implantations en attendant une rectification du dispositif, pour une disponibilité début 2024. La FDA a également émis un avertissement car le PDS a été associé à un taux d’endophtalmie trois fois plus élevé par rapport aux injections intra-vitréennes mensuelles de ranibizumab.
La thérapie génique
La thérapie génique a été utilisée avec succès dans les affections rétiniennes héréditaires comme l’amaurose congénitale de Leber ou certaines formes de rétinite pigmentaire (RP65). L’idée d’utiliser ces techniques dans la DMLA néovasculaire et la rétinopathie diabétique s’est naturellement imposée [14, 15].
Les vecteurs les plus utilisés dans les pathologies rétiniennes sont les AdenoAssociated Virus (AAV) qui ont une capacité de transduction dans plusieurs types cellulaires de la rétine et permettent l’introduction d’un ADN étranger dans la cellule hôte qui devient capable de transcrire le gène puis de produire une protéine fonctionnelle [16, 17]. Les vecteurs AAV ont un faible risque mutagène ou oncogène et sont peu immunogènes, contrairement à l’adénovirus ou au lentivirus. Ils ont démontré une excellente sécurité dans les études. Ils ont cependant une capacité de transfert génique limité (4,7 kb). Leur mode de conservation (– 80° C) nécessite une pharmacie équipée et habilitée pour le stockage et la distribution de matériel génétique, ce qui limite pour le moment leur utilisation à un nombre restreint de centres.
1. Mode d’administration des vecteurs viraux
Bien que les études révèlent de possibles réponses immunes dues au vecteur viral, l’isolation immunologique relative de l’œil et une très faible diffusion systémique du matériel génétique limitent les réponses inflammatoires. Le mode d’administration a également un impact majeur sur l’immunogénicité, la voie sous-rétinienne étant moins immunogène que l’intra-vitréenne.
L’injection sous-rétinienne nécessite une vitrectomie et reste invasive, mais permet la délivrance du vecteur viral directement aux cellules cibles (RPE). L’injection intra-vitréenne est moins invasive mais plus immunogène et l’accessibilité du vecteur viral aux cellules de la rétine externe est faible du fait de la présence de l’ILM (membrane limitante interne) qui agit comme une barrière physique.
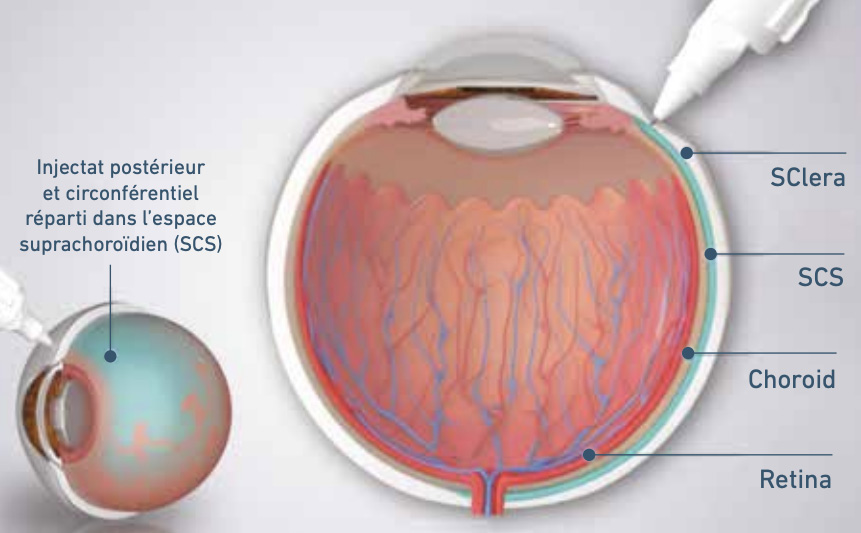
L’injection supra-choroïdienne [18] a l’avantage d’être peu agressive et de permettre une délivrance importante aux cellules cibles et a une immunogénicité faible (fig. 4 et 5).
2. Le RGX-314
Le RGX-314 de RegenXbio/AbbVie (fig. 5) a été développé pour la DMLA néovasculaire et la rétinopathie diabétique. Il s’agit d’un vecteur AAV8 qui délivre un gène qui code pour un anticorps anti-VEGF comparable au ranibizumab [19, 20].
>>> Une étude de phase I/IIa portant sur 42 patients a évalué la sécurité et la tolérance du RGX-314 dans la DMLA néovasculaire en injection sous-rétinienne avec cinq dosages croissants dans cinq cohortes. Les résultats à 2 ans montrent que le traitement est bien toléré avec une expression dose-dépendante de la molécule anti-VEGF. On constatait dans les cohortes 3 à 5 une diminution importante du nombre d’IVT de 58 % à 78 % sur 2 ans par rapport au traitement de référence (ranibizumab mensuel). Au suivi à 3 ans, les effets restent durables avec une AV stable ou améliorée et un nombre d’injections IVT d’anti-VEGF moyenne annuelle de 2,4 contre 6,8 durant les 12mois précédant l’étude [20].
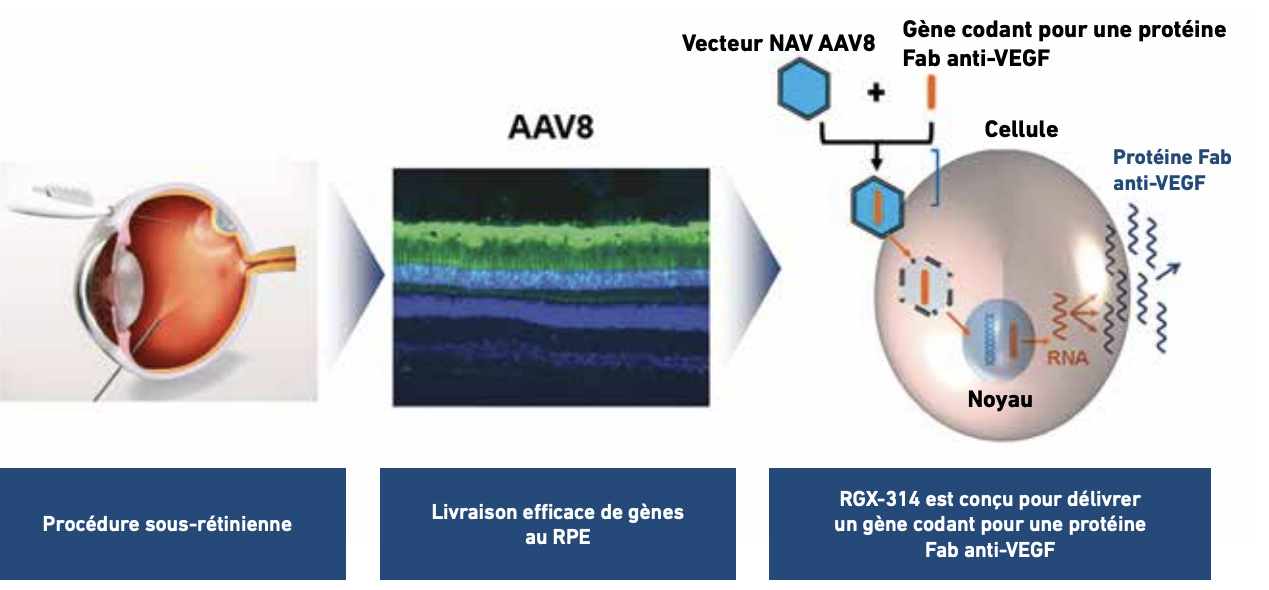
>>> L’étude de phase II AAVIATE a évalué l’efficacité du RGX-314 administré par voie supra-choroïdienne dans la DMLA grâce à un micro injecteur. L’étude a comparé trois dosages de RGX-314 sur cinq cohortes (85 patients) à des injections intra-vitréennes mensuelles de ranibizumab. Le traitement a été bien toléré dans les cinq cohortes en dehors de quelques cas modérés d’inflammation résolus par corticothérapie topique. À 6 mois, l’AV restait cependant légèrement supérieure chez les patients traités par ranibizumab mensuel. On constatait, dans les groupes traités par RGX-314, une vision stable et une réduction importante (de 64 à 85 %) du nombre d’IVT d’anti-VEGF comparées au nombre d’injections effectuées durant les 12 mois précédant l’étude [21].
>>> Une autre étude de phase II, ALTITUDE, a porté sur le RGX-314 en supra-choroïdien dans la rétinopathie diabétique sans œdème maclaire diabétique (OMD) chez 100 patients. On note une amélioration à 6 mois de 54 % du score DRSS de un à deux paliers, contre 20 % pour le contrôle.
>>> Deux études pivot de phase III de non-infériorité dans la DMLA néovasculaire sont en cours : ASCENT sur le RGX-314 comparé à l’aflibercept bimensuel (465 patients) et ATMOSPHERE sur le RGX-314 comparé au ranibizumab mensuel (300 patients). Le mode d’injection est sous-rétinien et les 1ers résultats intermédiaires devraient être disponibles en février 2025.
3. L’ixoberogene soroparvovec
L’ADVM-022 ou ixoberogene soroparvovec (Adverum Biotechnologies) est un vecteur AAV7m8 administré en injection intra-vitréenne qui code pour l’aflibercept.
>>> L’étude de phase I OPTIC montre que l’ADVM-022 est efficace et bien toléré à 3 ans en injection intra-vitréenne permettant une production stable et continue d’aflibercept. On constate le maintien de l’acuité visuelle, une amélioration des paramètres anatomiques et une réduction significative des injections d’anti-VEGF de 81 % [22, 23].
>>> L’étude de phaseII LUNA est en cours avec 72 participants: le vecteur ADVM022 est associé à plusieurs types de traitements anti-inflammatoires locaux, IVT ou généraux car il existe une préoccupation importante concernant la survenue de réaction inflammatoire pour ce vecteur.
>>> L’étude de phase II INFINITY a été interrompue dans le traitement de l’œdème maculaire diabétique du fait d’événements indésirables majeurs (hypotonie).
Conclusion
Les anti-VEGF sont actuellement administrés par voie intra-vitréenne nécessitant des visites fréquentes avec coût élevé pour la société. De nouveaux traitements ont été développés pour réduire cette fréquence tout en maintenant, voire améliorant, les résultats précédents. Certains, comme le brolucizumab, le faricimab et l’aflibercept 8 mg reprennent le même mode de délivrance intra-vitréen, d’autres sont plus disruptifs, comme le PDS.
La thérapie génique apporte l’espoir d’un traitement simplifié par une procédure unique mais qui nécessitera de se confronter à l’épreuve du temps, bien que les résultats préliminaires, notamment dans le RGX-314, soient très prometteurs. Ces traitements innovants resteront probablement un choix de 2e intention, au moins dans un 1er temps du fait de la difficulté de mise en œuvre et de leur coût comparé à celui des molécules anti-VEGF injectables de dernière génération, mais ils pourraient changer notre approche à plus long terme. Chacun devra trouver sa place parmi l’ensemble des possibilités thérapeutiques qui s’offriront à nous.
BIBLIOGRAPHIE
1. OMS. World report on vision; 2019.
2. Bakri S, Thorne J, Ho A et al. Safety and Efficacy of Anti-Vascular Endothelial Growth Factor Therapies for Neovascular Age-Related Macular Degeneration: A Report by the American Academy of Ophthalmology. Ophthalmology, 2019; 126:55-63.
3. Rosenfeld P, Brown D, Heier J et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med, 2006;355:1419-1431.
4. Heier J, Brown D, Chong V et al. Intravitreal aflibercept (VEGF trapeye) in wet age related macular degeneration. Ophthalmology, 2012;119: 2537-2548.
5. Rofagha S, Bhisitkul R, Boyer D et al. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA, and HORIZON: a multicenter cohort study (SEVEN-UP). Ophthalmology, 2013;120:2292-2299.
6. Silva R, Berta A, Larsen M et al. Treatand-extend versus monthly regimen in neovascular age-related macular degeneration: results with ranibizumab from the TREND Study. Ophthalmology, 2018;125:57-65.
7. Ohji M, Takahashi K, Okada AA et al. Efficacy and safety of intravitreal aflibercept treat and-extend regimens in exudative age-related macular degeneration: 52- and 96-week findings from ALTAIR: a randomized controlled trial. Adv Ther, 2020;37:1173-1187.
8. Dugel PU, Singh RP, Koh A et al. HAWK and HARRIER: ninety-six-week outcomes from the Phase 3 trials of brolucizumab for neovascular age-related macular degeneration. Ophthalmology, 2021;128:89-99.
9. Khanani A, Heier J, Ruiz CQ et al. Faricimab in neovascular age-related macular degeneration: 1-year efficacy, safety, and durability in the Phase 3 TENAYA and LUCERNE trials. Invest Ophthalmol Vis Sci, 2021;62:428.
10. Sarkar A, Junnuthula V, Dyawanapelly S. Ocular Therapeutics and Molecular Delivery Strategies for Neovascular Age-Related Macular Degenerationn (nAMD). Int J Mol Sci, 2021;22, 10594.
11. Khanani A, Callanan D, Dreyer R et al. End-of-study results for the ladder phase 2 trial of the port delivery system with ranibizumab for neovascular age-related macular degeneration. Ophthalmol Retin, 2021;5:775-787.
12. Holekamp N, Campochiaro P, Chang M et al. Archway randomized phase 3 trial of the port delivery system with ranibizumab for neovascular age-related macular degeneration. Ophthalmology, 2021;129:295-307.
13. Clinicaltrials.gov (2021a). A multicenter, randomized study in participants with diabetic retinopathy without center-involved diabetic macular edema to evaluate the efficacy, safety, and pharmacokinetics of ranibizumab delivered via the Port Delivery System relative to the comparator arm (PAVILION). Consultable sur: https://clinicaltrials.gov/ct2/show/NCT04503551
14. Guimaraes TAC et al. Gene therapy for neovascular age-related macular degeneration: rationale, clinical trials and future directions. Br J Ophthalmol, 2021;105:151-157.
15. Tan C, Ngo WK, Chay I et al. Neovascular Age-Related Macular Degeneration (nAMD): A Review of Emerging Treatment Options. Clinical Ophthalmology, 2022;16:917-933.
16. Wang D, Tai PWL, Gao G. Adenoassociated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov, 2019;18:358-378.
17. Liu Y, Fortmann SD, Shen J et al. AAV8- antiVEGFfab ocular gene transfer for neovascular age-related macular degeneration. Mol Ther, 2018;26:542-549.
18. Ding K, Shen J, Hafiz Z et al. AAV8- vectored suprachoroidal gene transfer produces widespread ocular transgene expression. J Clin Invest, 2019;129:4901-4911.
19. Regenxbio Inc. Safety and tolerability of RGX-314 gene therapy for neovascular AMD trial. Consultable sur : http://clinicaltrials.gov/ct2/show/NCT03066258.
20. Ho A. Subretinal delivery of RGX-314 for neovascular AMD: end of Phase I/ IIa study results, 2021. Consultable sur: https://regenxbio.com/wpcontent/ uploads/2021/10/RGX-314_Ph1-2a_data_Allen-Ho_Retina_Society_Oct2021.pdf
21. K h a n a n i AM. Suprachoroidal Delivery of RGX-314 Gene Therapy for Neovascular AMD: The Phase II AAVIATE Study. Investig Ophthalmol Vis Sci, 2022;63,1497.
22. Gelfman CM, Grishanin R, Bender KO et al. Comprehensive preclinical assessment of ADVM-022, an intravitreal anti-VEGF gene therapy for the treatment of neovascular AMD and diabetic macular edema. J Ocul Pharmacol Ther, 2021;37:181-190.
23. Khanani A. ADVM-022 intravitreal gene therapy for neovascular AMD- phase 1 OPTIC study, 2021. Consultable sur: https://adverum.com/wp-content/
uploads/2021/10/OPTIC-RetinaSociety-Meeting-Updated-9-30-2021a.
pdf
_
L’auteur a déclaré ne pas avoir de liens d’intérêts concernant les données publiées dans cet article.



